Ons klinische programma voor filgotinib voor CD
Filgotinib bevindt zich momenteel in Fase 2 van de klinische ontwikkeling voor CD en heeft een gunstige activiteit laten zien in preklinische modellen voor IBD. Op 6 augustus 2015 hebben we de afronding bekendgemaakt van de werving van deelnemers voor FITZROY, onze Fase 2 studie naar behandeling van CD met filgotinib. Deze studie, waarvoor 175 patiënten met CD werden ingesloten, had als doel het evalueren van het intreden van ziekteremissie binnen 10 weken. Ook wordt de klinische respons en andere effectiviteits- en veiligheidsparameters gemeten na maximaal 20 weken behandeling. Er werden patiënten geworven via 49 centra in Oost- en West-Europa. We hebben in december 2015 resultaten van 10 weken behandeling in de CD-studie bekendgemaakt en we verwachten in april 2016 de resultaten van 20 weken behandeling te kunnen presenteren. Mits we goedkeuring verkrijgen van de toezichthoudende instanties, zal er naar verwachting in 2016 een wereldwijd klinisch Fase 3 programma in CD worden opgestart.
Hieronder geven we een overzicht van de opzet van de klinische studie FITZROY.
|
Studie naam |
FITZROY (GLPG0634-CL-211) |
|---|---|
|
Studie ontwerp |
Dubbelblind, placebo-gecontroleerd als toevoeging aan stabiele achtergrond therapie (bijv.corticosteroïden, aminosalicylaten of Crohn’s-gerelateerde antibiotica). Twee studie delen: 10 weken deel 1 + re-randomisatie + 10 weken deel 2. Deel 1 - twee studie armen:
Deel 2 - drie studie armen:
|
|
Patiënten populatie |
Patiënten met actieve ziekte van Crohn met bewijs van verzwering van het darmslijmvlies |
|
Doel van de studie |
Proof-of-concept studie van filgotinib voor de behandeling van actieve ziekte van Crohn. |
|
Aantal gerandomiseerde patiënten |
175 |
|
Totale duur van de behandeling |
20 weken |
|
Primair doel van de studie |
Op week 10: effectiviteit in termen van het percentage van patiënten dat een klinische remissie (CDAI score van minder dan 150) bereikt na 10 weken behandeling in vergelijking tot placebo |
|
Secundaire doelen van de studie |
|
In december 2015 hebben we bekendgemaakt dat we het 10-weken primaire eindpunt in FITZROY hadden behaald:
FITZROY Studie CDAI Scores ITT-NRI, week 10
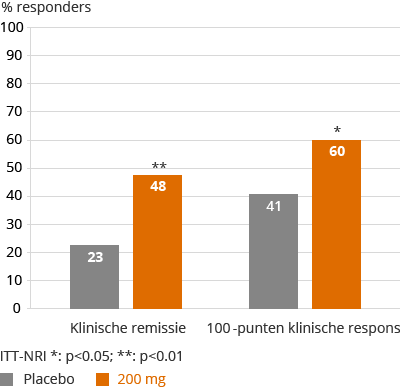
Over het algemeen blijkt uit de FITZROY studie na 10 weken behandeling, dat filgotinib een gunstig veiligheidsprofiel laat zien, consistent met de voorgaande DARWIN studies in reuma. De aard en frequentie van SAE’s en AE’s die werden geobserveerd was vergelijkbaar tussen filgotinib en placebo. De meerderheid van de SAE’s was gerelateerd aan de verslechtering door de ziekte van Crohn. In de FITZROY studie heeft filgotinib een gunstig lipideprofiel laten zien met een verhoging in HDL en geen verandering in LDL, wat resulteerde in een verbeterde atherogene index. Een verhoging in hemoglobine werd ook geobserveerd in FITZROY, zonder verschil tussen filgotinib en placebo. In deze studie zijn op 10 weken geen opvallende veranderingen in neutrofielen of leverfunctietesten ten opzichte van de basiswaarden geobserveerd.
We verwachten de definitieve resultaten van de studie met de 20-weken data in april 2016. Gilead is van plan om, afhankelijk van de succesvolle uitkomst van discussies met toezichthouders, Fase 3 studies met filgotinib in de ziekte van Crohn te starten in 2016.
Fase 1 studie / Preklinische studie
In een preklinische studie heeft Galapagos resultaten behaald die een veelbelovende activiteit laten zien in een model met DSS (dextraannatriumsulfaat) geïnduceerde colitis in muizen. In de eerder beschreven klinische Fase 1 studies met filgotinib hebben we een aanhoudend effect van JAK1-remming gedurende een periode van 24 uur aangetoond, met een kleine kans op interacties met andere geneesmiddelen.
Colitis ulcerosa
Colitis ulcerosa is een inflammatoire darmziekte die een chronische ontsteking van het slijmvlies van de dikke darm en rectum veroorzaakt. In tegenstelling tot de ziekte van Crohn, veroorzaakt colitis ulcerosa alleen ontstekingsbeschadigingen in de dikke darm en het rectum. De ziekte wordt vaak zichtbaar in jong volwassenen. In patiënten met matige tot ernstige colitis ulcerosa zijn de symptomen onder andere bloedige ontlasting, bloedarmoede, pijn, koorts en gewichtsverlies. In 2012 waren er in de Verenigde Staten bijna 625.000 mensen met colitis ulcerosa, volgens een rapport van GlobalData EpiCast uit december 2013.
Het uiteindelijke doel in de behandeling van colitis ulcerosa is het natuurlijke verloop van de ziekte te veranderen door het vertragen of stoppen van de progressie, waardoor chirurgische ingrepen of hospitalisatie worden vermeden. De huidige standaardbehandeling voor lichte tot matige colitis ulcerosa is 5-aminosalicylaten, of 5-ASA, oraal of rectaal gedoseerd. Deze geneesmiddelen verminderen de ontsteking in het slijmvlies van de darmen. Voor patiënten die niet op 5-ASA reageren zijn er andere behandelingen zoals corticosteroïden, immuno-modulatoren, biologische therapieën, zoals anti-TNF middelen, en cyclosporine. Chirurgische tussenkomst kan nodig zijn voor patiënten die ook niet op deze middelen reageren. De wereldwijde markt voor colitis ulcerosa therapieën was ongeveer $4,2 miljard in 2012 en zal naar schatting oplopen tot $6,7 miljard in 2022, voornamelijk als gevolg van het gebruik van biologische therapieën, volgens een GlobalData PharmaPoint rapport van september 2014.
De afgelopen tien jaar hebben de veranderingen in behandelingsstrategieën voor colitis ulcerosa, gedreven door de ontwikkeling van geneesmiddelen en de toevoeging van gerichte biologische therapieën, sterke verbeteringen voor de patiënten opgeleverd. Hoewel gebruik van anti-TNF middelen de behandeling van patiënten drastisch veranderd heeft, zal slechts een derde of minder van de patiënten hiermee tot langdurige remissie worden gebracht, en veel van die patiënten reageren uiteindelijk niet meer. Bovendien hebben anti-TNF middelen bijwerkingen waaronder verhoogde kans op infecties. Als zodanig is de medische nood voor deze patiënten nog steeds significant.
De belangrijkste bestaande actieve stoffen van UC-therapieën worden in de onderstaande tabel weergegeven:
|
Actieve stof |
Medicijn klasse |
Producent |
|---|---|---|
|
infliximab |
Anti-TNF |
Johnson & Johnson |
|
adalimumab |
Anti-TNF |
AbbVie |
|
golimumab |
Anti-TNF |
Johnson & Johnson |
|
vedolizumab |
Integrine remmer |
Takeda |
|
AZA |
Purine analog (immunosuppressor) |
generiek |
|
cyclosporine |
Immuun modulator |
generiek |
|
mesalamime |
5-ASA |
Shire |
|
mesalamime |
5-ASA |
Actavis |
|
mesalamime |
5-ASA |
Salix |
|
mesalamime |
5-ASA |
Ferring |
|
budesonide MMX |
glucocorticoide steroide |
Salix |
Galapagos denkt dat filgotinib kan worden toegepast voor de behandeling van UC. Van Xeljanz is aangetoond dat het werkzaam was in studies met UC-patiënten. Gezien de hogere selectiviteit voor JAK1 van filgotinib en de verbetering van het hemoglobinegehalte die is aangetoond met filgotinib in meerdere Fase 2 studies met patiënten met onder andere de ziekte van Crohn, is het mogelijk dat de verhouding tussen de risico’s en voordelen van filgotinib aantrekkelijker zal zijn dan die van tofacitinib voor patiënten met UC.
In 2015 hebben we een proof-of-concept studie gedaan met GLPG1205, een krachtige en selectieve remmer van GPR84 in patiënten met colitis ulcerosa. Op 26 januari 2016 hebben we de resultaten van deze ORIGIN Fase 2a studie bekendgemaakt. Deze bevestigden de goede medicijneigenschappen, veiligheid en dat het goed verdragen werd. De eindpunten voor werkzaamheid in colitis ulcerosa werden echter niet behaald en daarom hebben we de klinische ontwikkeling van GLPG1205 in colitis ulcerosa stopgezet.
