Galapagos' filgotinib programma voor reuma
Galapagos ontwikkelt een zeer selectieve JAK1 remmer, filgotinib, voor de behandeling van reuma en hiervan verwacht Galapagos dat het een aantal van de beperkingen van de huidige reuma behandelingen kan voorkomen. In een door Galapagos ontwikkelde menselijke bloedtest werd aangetoond dat filgotinib, in vergelijking met andere ons bekende JAK-remmers die ofwel zijn goedgekeurd voor verkoop of in klinische ontwikkeling zijn voor de behandeling van reuma, selectiever is voor JAK1. Filgotinib laat een 30-voudige selectiviteit voor JAK1 ten opzichte van JAK2 zien. Galapagos verwacht dat de hoge selectiviteit van filgotinib voor JAK1, ten opzichte van andere erkende reuma therapieën, de mogelijkheid biedt op een gelijkaardige of betere werkzaamheid terwijl het veiligheidsprofiel beter zal zijn als gevolg van de betere selectiviteit van filgotinib ten opzichte van JAK2 en JAK3.
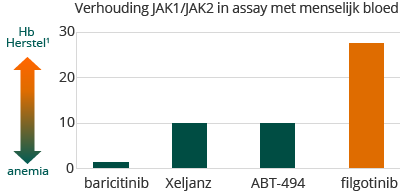
1 A. Tefferi, Blood 119 (2012) 2771-2730
Bovendien biedt filgotinib de mogelijkheid om gebruikt te worden als een éénmaal daagse orale therapie, wat potentieel tot een gemakkelijkere toedieningsmethode en hogere therapietrouw van patiënten zal leiden. Filgotinib heeft een profiel dat potentieel gebruik in combinatie met andere geneesmiddelen toelaat, hetgeen een belangrijke eigenschap is voor een behandeling in deze patiëntenpopulatie omdat de meeste van deze patiënten ook gelijktijdig op andere therapieën zitten omwille van comorbiditeiten of andere ziekten.
Door het DARWIN klinische programma heeft Galapagos aangetoond dat filgotinib voldoet aan de volgende klinische en producteffecten voor de behandeling van reuma:
- Veiligheid: Dat filgotinib goed werd verdragen, niet tot behandeling geïnduceerde bloedarmoede, noch tot toename van de LDL/HDL balans heeft geleid, en een lager totaal infectiepercentage heeft in vergelijking met andere goedgekeurde therapieën in reuma, evenals een gunstig profiel voor leverenzymen
- Werkzaamheid: Dat filgotinib een snelle aanvang van de werkzaamheid, door ACR20 respons gemeten, met een duurzaam effect heeft laten zien, gelijk aan of beter dan die van goedgekeurde biologische geneesmiddelen en therapieën zoals anti-TNF’s
- Gemak: Dat filgotinib een oraal, eenmaal daagse toediening toelaat
- Combinatie met andere therapieën: Dat filgotinib vanwege het ontbreken van negatieve wisselwerkingen met andere geneesmiddelen kan worden gecombineerd met andere therapieën die vaak voorgeschreven worden bij reumapatiënten
Filgotinib is geëvalueerd in de DARWIN 1 en 2 Fase 2b studies bij patiënten met matige tot ernstige RA en die niet voldoende reactie hebben laten zien met methotrexaat (MTX). Het doel van deze studies was om de optimale dosering voor filgotinib te kunnen vaststellen. Patiënten die een Fase 2b studie hebben afgerond hadden de mogelijkheid om door te gaan in DARWIN 3, een lange termijn vervolgstudie die patiënten de mogelijkheid biedt om door te gaan met de behandeling, indien zij en hun behandelende arts dat wensten. De primaire doelstelling van de DARWIN 1 en 2 studies is de werkzaamheid vaststellen in termen van percentages van patiënten die een ACR20 score behaalden na 12 weken behandeling. Eindresultaten na 24 weken van behandeling in beide DARWIN studies zijn bekendgemaakt in juli en augustus 2015 en gaven meer inzicht over het veiligheidsprofiel vanwege het feit dat patiënten gedurende een langere periode behandeld waren. Secundaire studiedoelen omvatten werkzaamheid in termen van percentages van patiënten die een ACR20 score behaalden na 24 weken behandeling, een ACR50 en ACR70 score behaalden en verbeteringen in andere ziekte-activiteit metingen, naast evaluatie van veiligheid en verdraagzaamheid en effecten op beperkingen, vermoeidheid en kwaliteit van leven bij patiënten.
Hieronder een overzicht van de studie opzet voor het klinische DARWIN programma:
|
Studie naam |
DARWIN 1 (GLPG0634-CL-203) |
DARWIN 2 (GLPG0634-CL-204) |
|---|---|---|
|
Studie ontwerp |
Dubbelgeblindeerd, placebogecontroleerd |
|
|
Toevoeging aan MTX Zeven studie armen:
|
Monotherapie Vier studie armen:
|
|
|
Patiënten populatie |
Patiënten met een matige tot ernstige RA en een inadequate reactie op MTX (oraal of parenteraal) |
|
|
Doel van de studie |
Fase 2b dose finding studie om: |
|
|
|
|
|
||
|
Aantal gerandomiseerde patiënten |
599 (594 behandeld) |
287 (283 behandeld) |
|
Totale duur van de behandeling |
24 weken |
|
|
Re-randomisatie |
Op week 12 worden patiënten op placebo of lage dosis van filgotinib die nog geen 20% verbetering hebben van SJC 66 of TJC 68 score automatisch gererandomiseerd in een andere studie arm met een dosis van 50 of 100mg. Patiënten in de overige groepen blijven op hun gerandomiseerde behandeling tot week 24 |
|
|
Primaire doel van de studie (op week 12) |
Effectiveit in termen van het percentage van patienten bij wie sprake is van een ACR20-respons voor: |
|
|
|
|
|
Secundaire doelen van de studie (op elke controle) |
Effectiviteit in termen van het percentage patiënten dat een ARC20, ACR50, ACR70 en DAS28 (CRP) respons behaald en andere ziekteactiviteit metingen Veiligheid en verdraagzaamheid Effecten op de beperkingen, moeheid en kwaliteit van leven van de patient voor: |
|
|
|
|
|
De medicijneigenschappen van filgotinib en zijn metaboliet in patiënten met RA en de relatie tussen de blootstelling en effectiveit/veiligheid/ |
||
DARWIN 3 (GLPG0634-CL-205) is een multicenter, open-label, lange termijn vervolg veiligheids- en werkzaamheidstudie van patiënten die of DARWIN 1 of DARWIN 2 afgerond hebben. Alle patiënten zijn de studie begonnen op dezelfde dosis, dat is ofwel eenmaal per dag 200 mg of 100 mg tweemaal per dag (behalve mannen in de Amerikaanse centra van de studie, zij krijgen een maximale dosis van 100 mg per dag), afhankelijk van het inname regiment tijdens de voorgaande studie, met DARWIN 1 patiënten die een combinatie gebruiken van filgotinib met MTX.
In het kader van het DARWIN klinische programma, zijn we akkoord gegaan met de FDA om de 200 mg filgotinib dagelijkse dosis voor mannelijke patiënten uit te sluiten; mannen in de Verenigde Staten krijgen een maximale dosis van 100 mg per dag in deze studie. Deze beperking werd niet opgelegd door enige andere toezichthouder in enige andere jurisdictie waarin het DARWIN klinische programma is gehouden. Zie: “Risico Factoren – Risico’s gerelateerd aan productontwikkeling, goedkeuring van de bevoegde gezondheidsinstanties en commercialisatie.”
Metingen van reuma
De ernst van reuma kan worden beoordeeld aan de hand van diverse indexen, volgens de aanbevelingen van het ACR (Amerikaans College van Reumatologie). De criteria van het ACR meten de verbetering van het aantal pijnlijke of gezwollen gewrichten en omvatten klinische parameters waarbij rekening wordt gehouden met de beoordeling van de beperkingen door de patiënt en de arts. Deze parameters ten aanzien van de ziekteactiviteit worden gecombineerd om samengestelde percentages voor de klinische respons te vormen, die bekend staan als ACR20, ACR50 en ACR70. De score ACR20 vertegenwoordigt een verbetering van 20% in deze criteria en wordt beschouwd als bescheiden verbetering in de ziekte van een patiënt. De scores ACR50 en ACR70 vertegenwoordigen een verbetering van, respectievelijk, 50% en 70% in de klinische responscriteria, en beide worden beschouwd als bewijs van een belangrijke verbetering in de ziekte van een patiënt.
In juli 2015 heeft Galapagos verslag gedaan van de definitieve resultaten van DARWIN 1 na 24 weken behandeling. DARWIN 1 was een 24 weken durende, dubbelgeblindeerde, placebogecontroleerde evaluatie van filgotinib, eenmaal daags (QD) en tweemaal daags (BID) toegediend, met drie dagelijkse dosisniveaus. De definitieve resultaten hadden betrekking op 594 patiënten met matige tot ernstige reumatoïde artritis die onvoldoende op MTX reageerden en die hun behandeling met MTX op de achtergrond voortzetten. Deze patiënten kregen filgotinib of placebo en werden maximaal 24 weken geëvalueerd. Wij hebben de primaire doelstelling qua ACR20 respons na 12 weken behandeling behaald, door vervolgens de een ACR20 score van 80% bij 100 mg filgotinib tweemaal daags te laten zien tegenover 45% voor placebo. We hebben later ook volgende ACR50 scores na 12 en 24 weken behandeling gerapporteerd:
ACR50 SCORES
DARWIN 1, ITT-NRI
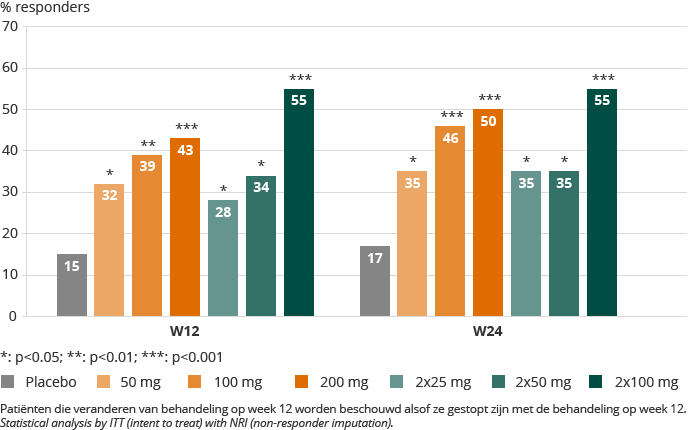
Over het algemeen bleek er geen statistisch relevant verschil tussen één- en tweemaal dagelijkse inname.
Binnen alle de DARWIN 1 groepen, inclusief de placebogroep, is 3,9% van de patiënten tijdens de studie gestopt met de behandeling vanwege veiligheidsredenen. Patiënten die ernstige (2,5%) behandeling gerelateerde negatieve effecten rapporteerden waren gelijk verdeeld over de doseringsgroepen, inclusief de placebogroep. Bij zes patiënten werden serieuze infecties vastgesteld, inclusief één overlijden tijdens actieve behandeling in de tweede helft van de studie, waarvoor de Data Safety Monitoring Board geen reden zag om de studie te onderbreken of stop te zetten. Er werden geen opportunistische infecties gerapporteerd. Evenredig verdeeld over de placebo en filgotinib groepen kwam bij vijf patiënten herpes zoster voor. Consistent met de eigenschappen van een selectieve JAK1-remmer, leidde behandeling met filgotinib tot een stijging van hemoglobine (tot aan 0,5 g/dl, of een 4% stijging ten opzichte van de beginwaarde). Alle lipidefracties inclusief HDL en LDL stegen, met de hoogste percentuele stijging in HDL. De behandeling met filgotinib in deze studie leidde niet een verandering in lymfocyten. Er werden geen klinisch opvallende veranderingen in, noch stopzettingen omwille van, bloedconcentraties van mannelijke geslachtshormonen vastgesteld.
In augustus 2015 heeft Galapagos de resultaten van 24 weken behandeling in de DARWIN 2 studie bekendgemaakt. DARWIN 2 was een 24-weekse, dubbel geblindeerde, placebo-gecontroleerde evaluatie van filgotinib, als eenmaal daagse inname (q.d. dosering) op drie niveaus van dosering. DARWIN 2 resultaten gingen over 283 patiënten met matige tot ernstige reuma, die onvoldoende reageerden op MTX. Filgotinib of placebo werd gegeven als monotherapie, na stopzetten van de MTX behandeling. De patiënten werden gedurende 24 weken geëvalueerd. Galapagos bereikte het primaire eindpunt van de ACR20 score met alle drie de doseringen op 12 weken, vervolgens werden de volgende ACR50 scores rapporteren op 12 en 24 weken eenmaal daagse monotherapie gerapporteerd:
ACR50 SCORES
DARWIN 2, ITT-NRI
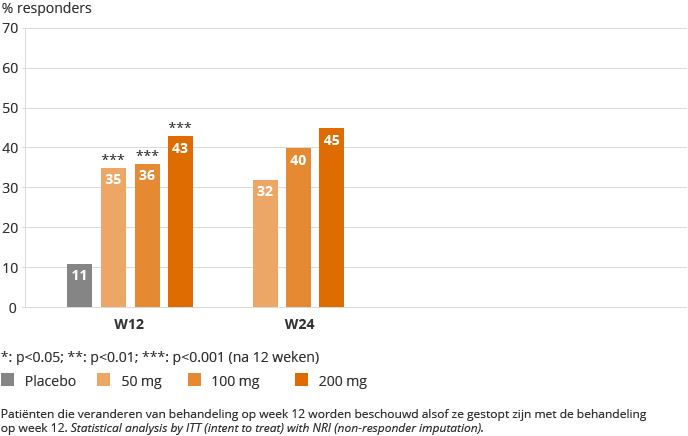
De resultaten van DARWIN 2 lieten een snelle werkzaamheid zien vanaf week één voor ACR en DAS8 (CRP) scores. Maximale ACR20 en ACR 50 scores werden behaald op respectievelijk week 8 en week 12. Een verdere verbetering werd gerapporteerd voor ACR en DAS28 (CRP) gedurende de tweede helft van de studie. In de groepen met de hoogste dosering werd tot aan 50% van de patiënten een DAS-status van ‘lage ziekte activiteit’ of ‘remissie’ bereikt.
In alle DARWIN 2 doseringsgroepen, inclusief de placebogroep, zijn 3.9% van de patiënten gestopt met de behandeling vanwege veiligheidsredenen. Een hoger percentage van stopzetting vanwege veiligheid werd geobserveerd voor placebo (5.6%) gedurende de eerste 12 weken van de studie vergeleken met patiënten behandeld tot aan week 24 met filgotinib (2.5%). Vergelijkbare gevallen van ernstige en niet-ernstige behandeling gerelateerde negatieve bijwerkingen zijn gerapporteerd, evenredig verdeeld over de doseringsgroepen inclusief placebo. Een hoger percentage van infecties werd geobserveerd in filgotinib (19% in 24 weken) vergeleken met placebo (10% tot aan 12 weken), met gelimiteerde serieuze infecties (1.4% van filgotinib patiënten). Geen maligniteiten, tuberculose, ernstig hartfalen, opportunistische infecties of overlijden zijn gerapporteerd. Consistent met de eigenschappen van een selectieve JAK1-remmer, leidde behandeling met filgotinib tot een stijging van hemoglobine (tot aan 0,4 g/dl, of een 3.6% stijging ten opzichte van de beginwaarde). Neutrofielwaarden bleven stabiel na een eerste daling tot een mid-normaal niveau op vier weken. Er was geen invloed op lymfocyten of leverfunctietesten. De gelijke toename in LDL en HDL bleef gehandhaafd. Er werden geen klinisch opvallende veranderingen in, noch stopzettingen omwille van, bloedconcentraties van mannelijke geslachtshormonen vastgesteld.
