Eerdere klinische studies met filgotinib in RA
Fase 2a proof-of-concept studie
In november 2011 hebben we resultaten bekendgemaakt van onze Fase 2a proof-of-concept studie (GLPG0634-CL-201), een vier weken durende studie met reumapatiënten die onvoldoende reageerden op behandeling met alleen MTX. Deze studie was een gerandomiseerde, dubbelgeblindeerde, placebogecontroleerde studie die werd uitgevoerd in één centrum. In totaal werden er 36 patiënten gerandomiseerd met een verdeelsleutel van 1:1:1 voor behandeling met filgotinib 100 mg (tweemaal daags), 200 mg (eenmaal daags) of placebo, terwijl zij hun standaardbehandeling met MTX eveneens verderzetten. Alle gerandomiseerde patiënten hebben de studie afgerond.
In de studie werd in week vier een score van ACR20 behaald door circa 92% (p‑waarde t.o.v. placebo = 0,0094), 75% (p-waarde t.o.v. placebo = 0,0995) en 33% in de groepen van respectievelijk 100 mg (tweemaal daags), 200 mg (eenmaal daags) en placebo. Bij tot wel 40% van de patiënten die werden behandeld met filgotinib was er bovendien sprake van ziekteremissie of een lage ziekteactiviteit. Het verschil in het aantal patiënten met een score van ACR20 in week vier was statistisch significant voor de samengevoegde filgotinib-groep ten opzichte van de placebogroep (p-waarde t.o.v. placebo = 0,0067).
Er zijn geen ernstige ongewenste effecten (SAE’s) gemeld van patiënten die actief werden behandeld met diverse doseringen en doseringsschema’s van filgotinib. Van de met filgotinib behandelde patiënten heeft bovendien niemand de behandeling permanent stopgezet. De mediaan laboratoriumwaarden en p‑waarden werden visueel geïnspecteerd op trends in de tijd, maar er is geen statistische analyse van trends in de tijd uitgevoerd. Uit deze analyses zijn geen klinisch relevante trends of veranderingen naar voren gekomen, behalve een daling van de trombocytentelling in beide met filgotinib behandelde groepen. De parameters ten aanzien van de vitale functies en het elektrocardiogram (ECG) werden niet beïnvloed door filgotinib. Al met al hebben de resultaten van deze proof-of-concept-studie onder patiënten met RA aangetoond dat een dagelijkse dosis van 200 mg filgotinib naast MTX een veelbelovende activiteit laat zien en over het algemeen goed werd verdragen tijdens vier weken van behandeling.
Fase 2a studie met verschillende doseringen
In november 2012 heeft Galapagos resultaten bekendgemaakt van de Fase 2a vervolgstudie met verschillende doseringen (GLP0634- CL-202) ter bevestiging van het tijdens de Fase 2 proof-of-concept studie waargenomen veiligheidsprofiel. Deze studie was een vier weken durende, gerandomiseerde, dubbelgeblindeerde, placebogecontroleerde studie met verschillende doseringen onder patiënten met actieve RA die niet voldoende reageerden op MTX, uitgevoerd in 4 landen en met medewerking van 19 centra. In totaal werden er 91 patiënten gerandomiseerd met een verdeelsleutel van 1:1:1:1:1 voor doseringsschema’s van eenmaal daags 30 mg filgotinib, 75 mg filgotinib, 150 mg filgotinib, 300 mg filgotinib of placebo gedurende vier weken.
In deze studie werd in week vier een score van ACR20 behaald door 35% (p-waarde t.o.v. placebo = 0,736), 55% (p-waarde t.o.v. placebo = 0,456), 40% (p-waarde t.o.v. placebo = 0,834), 65% (p-waarde t.o.v. placebo = 0,111) en 41% voor, respectievelijk, doseringen van 30 mg, 75 mg, 150 mg, 300 mg en placebo. De algehele activiteit van filgotinib werd bevestigd over een breed scala van parameters. Onevenwichtigheden in behandelgroepen qua demografie en ziektekenmerken en de beperkte grootte van elke behandelgroep zijn mogelijke verklaringen voor de relatief hoge ACR20-respons in de placebogroep en de gevonden lage ACR20-respons in de met eenmaal daags 150 mg filgotinib behandelde groep. Al met al werden er meer consistente en dosisgerelateerde resultaten tussen behandelingsgroepen gevonden voor objectieve metingen van de ziekteactiviteit, zoals C-reactief proteïne (CRP) in serum, en voor de beoordeling van de ziekte door de arts, zoals het aantal gezwollen gewrichten (Swollen Joint Counts, SJC), het aantal pijnlijke gewrichten (Tender Joint Counts, TJC), en de algemene beoordeling van de arts, in vergelijking met subjectieve beoordelingen van proefpersonen, d.w.z. algemene beoordeling en beoordeling van de pijn en invaliditeitsindex op basis van een vragenlijst over de gezondheid (Health Associated Questionnaire – Disability Index (HAQ-DI)). Dit was vooral evident in de groep met de dosering van 150 mg, waarin de proefpersonen een hogere SJC en TJC op uitgangsniveau hadden dan in de andere studiearmen, en het kan hebben geleid tot minder opgemerkte verbetering van de pijn en de algemene Visual Analog Scale (VAS), resulterend in een slechtere ACR-respons. De doseringen van 50, 100 en 200 mg voor het DARWIN Fase 2b programma zijn gekozen op basis van de uitkomsten van deze studie.
Er zijn geen ernstige negatieve effecten gemeld van patiënten die actief werden behandeld met verschillende doseringen filgotinib. Van de met filgotinib behandelde patiënten heeft ook niemand de behandeling permanent gestaakt. In de laboratoriumparameters werden geen medisch significante veranderingen ten opzichte van het uitgangsniveau gevonden. Alle doseringen filgotinib werden goed verdragen. Het veiligheidsprofiel was bij deze studie niet anders dan bij de eerder met filgotinib uitgevoerde studies. De parameters ten aanzien van de vitale functies en het ECG werden niet significant beïnvloed door filgotinib.
Fase 1
Galapagos heeft filgotinib geëvalueerd in gezonde menselijke vrijwilligers in Fase 1-studies. Tot en met de hoogste dosering van 450 mg per dag werd filgotinib goed verdragen (er werd geen maximale verdraagbare dosering gevonden). Door de stofspecifieke metabolische transformatie heeft filgotinib met haar actieve metaboliet een halfwaardetijd van één dag, wat kan bijdragen aan de werkzaamheid bij toediening eenmaal daags (QD).
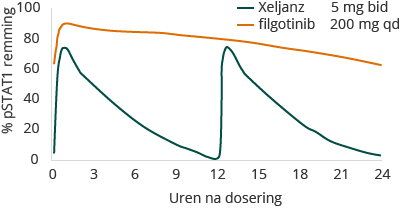
Verder is de kans op interacties tussen geneesmiddelen voor filgotinib en zijn belangrijkste metaboliet in vitro onderzocht, en bevestigd met midazolam (een gevoelige marker voor CYP3A4 activiteit) bij gezonde vrijwilligers en met MTX bij patiënten. Aangezien er geen interactie is tussen filgotinib en cytochroom P450-enzymen (of CYP) en het middel belangrijke geneesmiddeltransporters niet remt, verwachten wij dat filgotinib gelijktijdig met andere geneesmiddelen zou kunnen worden gebruikt zonder dat de dosis van filgotinib of deze gelijktijdige medicatie hoeft te worden aangepast.
